
Pembahasan soal Kimia Tes Kompetensi Akademik Sains dan Teknologi (TKA Saintek) pada Ujian Tulis Berbasis Komputer (UTBK) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun 2019 nomor 41 sampai dengan nomor 45 tentang:
- ikatan kimia,
- bentuk molekul,
- konsentrasi hasil titrasi,
- mol elektron, dan
- pH hasil titrasi.
Soal No. 41 tentang Ikatan Kimia

Unsur-unsur yang jika berpasangan membentuk senyawa yang bersifat paling basa adalah ….
| A. | M dan N |
| B. | M dan O |
| C. | N dan O |
| D. | N dan P |
| E. | P dan Q |
Pembahasan
Yang perlu diperhatikan adalah nomor atom (Z) dari unsur tersebut. Kemudian kita ingat kembali nomor atom gas mulia berikut ini:2, 10, 18, 36, 54, 86
Nomor atom pada tabel di atas kita kurangi dengan nomor atom gas mulia yang paling dekat dengan nomor atom tersebut.
| M | : | 4 − 2 = +2 |
| N | : | 8 − 10 = −2 |
| O | : | 9 − 10 = −1 |
| P | : | 12 − 10 = +2 |
| Q | : | 20 − 18 = +2 |
Ketentuan jenis ikatan:
| +, − | : | ikatan ion |
| −, − | : | ikatan kovalen |
| +, + | : | ikatan logam |
Opsi A, B, dan D berikatan ion. Opsi C berikatan kovalen sedangkan opsi E berikatan logam.
Senyawa yang bersifat asam/basa adalah senyawa yang berikatan ion. [opsi C dan E salah]
Sedangkan unsur M yang bernomor atom 4 bersifat amfoter, yaitu bisa bersifat asam atau basa. Ingat, unsur di dunia ini yang bersifat amfoter adalah 4Be dan 13Al. [opsi A dan B salah]
Dengan demikian, pasangan unsur yang bersifat paling basa adalah:
P2+ + N2− → PN
Jadi, pasangan unsur yang membentuk senyawa yang bersifat paling basa adalah N dan P (D).
Soal No. 42 tentang Bentuk Molekul
Jika unsur X dan Y bersenyawa, bentuk molekul senyawa yang terjadi adalah ….
| A. | jungkat-jungkit |
| B. | bentuk V |
| C. | piramida segitiga |
| D. | bujur sangkar |
| E. | segitiga planar |
Pembahasan
Konfigurasi elektron X dan Y adalah:X : [Ne] s2 p5 (7 elektron terluar)
Y : [Ne] s2 p3 (5 elektron terluar)
Unsur X mempunyai 7 elektron terluar sehingga membutuhkan 1 elektron agar tercapai kaidah oktet (8). Sedangkan unsur Y mempunyai 5 elektron terluar sehingga membutuhkan 3 elektron. Dengan demikian unsur Y berperan sebagai atom pusat yang mengikat 3 unsur X untuk membentuk senyawa YX3.

Seandainya tidak ada pasangan elektron bebas, bentuk molekul YX3 berupa segitiga planar atau segitiga datar.
Adanya elektron bebas, mengakibatkan unsur Y terangkat sehingga membentuk bangun ruang berupa limas segitiga atau segitiga piramida.
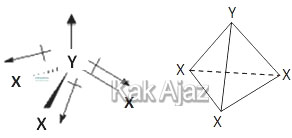
Jadi, bentuk molekul senyawa yang terjadi adalah piramida segitiga (C).
Bacaan untuk soal nomor 43 sampai dengan 45.
KBrO4 + 4SO2 + 4H2O → 4H2SO4 + KBr
Titik ekivalen tercapai saat volume KBrO4 yang digunakan sebanyak 50 mL.
Soal No. 43 tentang Konsentrasi Hasil Titrasi
| A. | 0,1 M |
| B. | 0,2 M |
| C. | 0,3 M |
| D. | 0,4 M |
| E. | 0,5 M |

Pembahasan
Konsentrasi SO2 dapat dicari melalui jumlah mol KBrO4.| n KBrO4 | = | M ∙ V |
| = | 0,1 M × 50 mL | |
| = | 5 mmol |
Berdasarkan koefisien reaksi, maka:
| n SO2 | = | 4/1 × n KBrO4 |
| = | 4/1 × 5 mmol | |
| = | 20 mmol |
Dengan demikian, molaritas SO2 adalah:
| [SO2] | = | n/V |
| = | 20/50 M | |
| = | 0,4 M |
Jadi, konsentrasi SO2 dalam larutan adalah 0,4 M (D).
Soal No. 44 tentang Mol Elektron
| A. | 0,02 mol |
| B. | 0,04 mol |
| C. | 0,08 mol |
| D. | 0,10 mol |
| E. | 0,12 mol |
Pembahasan
Mol elektron bisa ditentukan dari perubahan biloks dari salah satu setengah reaksi di atas. Misal kita cari perubahan biloks dari Br (boleh juga perubahan biloks S, hasilnya tetap sama).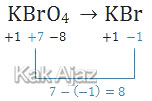
Dengan demikian, jumlah elektron yang terlibat dalam perubahan biloks Br adalah 8 elektron. Sedangkan jumlah mol elektronnya adalah:
| mol elektron | = | n × e |
| = | 5 mmol × 8 | |
| = | 40 mmol | |
| = | 0,04 mol |
Jadi, jumlah mol elektron yang terlibat dalam reaksi titrasi di atas adalah 0,04 mol (B).
Soal No. 45 tentang pH Hasil Titrasi
| A. | 4 |
| B. | 4 – log 2 |
| C. | 4 – 2log 2 |
| D. | 1 – log 2 |
| E. | 1 – 2log 2 |
Pembahasan
pH larutan kita tentukan dari spesi yang bersifat asam atau basa, yaitu H2SO4 (asam sulfat).Karena koefisien H2SO4 sama dengan koefisien SO2 maka jumlah molnya pun sama.
Volume H2SO4 (ruas kanan) merupakan gabungan volume KBrO4 dan SO2.
| V H2SO4 | = | 50 mL + 50 mL |
| = | 100 mL |
Sehingga konsentrasi H2SO4 adalah:
| [H2SO4] | = | n/V |
| = | 20/100 M | |
| = | 2 × 10−1 M |
Karena H2SO4 adalah asam kuat, perumusan pH yang berlaku adalah:
| [H+] | = | a ∙ M, [a : jumlah ion H+] |
| = | 2 × 2 × 10−1 | |
| = | 4 × 10−1 | |
| pH | = | 1 – log 4 |
| = | 1 – log 22 | |
| = | 1 – 2log 2 |
Jadi, pH larutan setelah titrasi adalah 1 – 2log 2 (E).
Simak Pembahasan Soal TKA Saintek UTBK SBMPTN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.


